ارتباط مستقیم با کارشناس فروش
انواع تکنیک های RFLP | Nested PCR | PCR | کلنی PCR
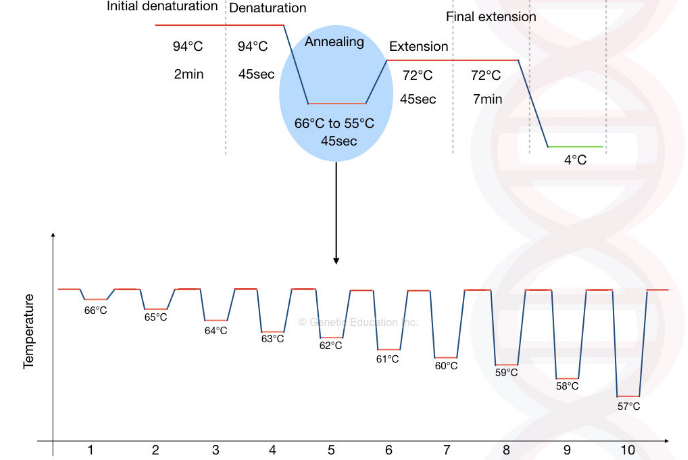
واکنش زنجیره ای پلیمراز
واکنش زنجیره ای پلیمراز یک فناوری بیولوژیکی برای تولید تعداد زیادی کپی DNA است. در این واکنش سه مرحله اصلی درگیر عبارتند از: باز شدن دو رشته از همدیگر، اتصال و گسترش. تکنیک های PCR کاربردهای زیادی در بیولوژی گیاهی، تشخیص بیماری های انسانی، سالمونلا، شبیه سازی، در زمینه دندانپزشکی، میکروبیولوژی، پزشکی قانونی و غیره دارد.
بسیاری از انواع تکنیک های PCR مانند RT-PCR ،touchdown PCR ،Real Time PCR ،Nested PCR ،multiplex PCR و بسیاری دیگر می باشد که به طور مختصر در مورد انواع مختلف تکنیک های PCR در چند بخش می پردازیم.
انواع مختلف تکنیک های PCR
Multiplex PCR
یک تکنیک بیولوژی مولکولی پرکاربرد است که جهت بررسی چند ژن در یک واکنش استفاده می شود.
در این راستا چند جفت پرایمر مختلف در یک واکنش به طور همزمان به کار برده می شود. در این نوع PCR به منظور افزایش بازده واکنش، بهینه سازی دمای اتصال پرایمر صورت میگیرد و استفاده از سیستم hot-start و بهینه سازی بافر مورد استفاده در واکنش برای یک PCR موفقیت آمیز multiplex کاملاً ضروری می باشد. در مقایسه با سیستمهای PCR استاندارد که فقط از 2 پرایمر استفاده میکنند، یک چالش دیگر Multiplex PCR،هیبریداسیون متفاوت جفتهای پرایمر مختلف است. پرایمرهایی که با راندمان بالا متصل می شوند می توانند از اجزای بیشتری از واکنش PCR استفاده کنند و در نتیجه بازده سایر محصولات PCR را کاهش دهند. این امر اغلب منجر به عدم تکثیر برخی از توالی های DNA و عدم وجود محصولات PCR مورد انتظار می شود. کیت های PCR تجاری موجود هستند که به طور خاص برای غلبه بر چالش های Multiplex PCR طراحی شده اند و توصیه می شود در صورت امکان از چنین کیتی استفاده شود.
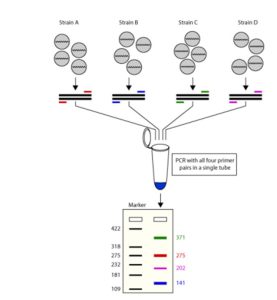
Multiplex PCR
انواع Multiplex PCR
به طور کلی به دو گروه تقسیم می شوند:
- واکنش PCR با یک الگو: در این تکنیک از یک نمونه به همراه چند جفت پرایمر به منظور تکثیر و تشخیص مناطق خاصی در نمونه استفاده می شود.
واکنش PCR با چند الگو: از چندین نمونه و چندین مجموعه پرایمر در یک واکنش استفاده می شود.وجود چند الگوی DNA منجر به اتصال اشتباه پرایمرها به الگوی اشتباه می شود.
برای اجرای موفق Multiplex PCR، استفاده از مسترمیکسهایی با ترکیب دقیق و عملکرد پایدار ضروری است. Multiplex PCR mastermix با فراهمسازی شرایط بهینه برای تکثیر همزمان چند قطعه ژنی، بازده بالا و تکرارپذیری دقیق را تضمین میکند. این مسترمیکس انتخابی مناسب برای تشخیص همزمان چند هدف ژنتیکی در یک واکنش است، بدون نیاز به بهینهسازیهای پیچیده.
روش Nested PCR – تکنیک Nested PCR
این نوع PCR برای افزایش ویژگی PCR به منظور تکثیر ناحیه مورد نظر در DNA الگو با هدف حذف ناحیه غیراختصاصی تکثیر شده به کمک دو پرایمر دیگر می باشد.
Nested PCR از دو مجموعه پرایمر و دو واکنش متوالی PCR استفاده می کند. اولین مجموعه پرایمرها برای تکثیر یک توالی DNA کمی طولانی تر از توالی مورد نظر طراحی شده است (خارج از محدوده توالی هدف) و پرایمر دوم در محدوده ی تکثیری مربوط به پرایمر اول که فقط ناحیه ی هدف را تکثیر می کند طراحی می شود. در این تکنیک اول با مجموعه ی اول یک واکنش PCR گذاشته می شود تا ناحیه بزرگتر در اطراف ناحیه هدف تکثیر شود و در مرحله ی بعدی از محصول واکنش اول در واکنش دوم استقاده میشود. بدین ترتیب که در واکنش دوم از محصول واکنش اول به همراه مجموعه دوم پرایمر استفاده میشود و بدین ترتیب الگو در این واکنش ناحیه تکثیری بزرگتر حاصل از مرحله اول می باشد.. در طی واکنش PCR دوم، مجموعه دوم پرایمرها که مخصوص توالی مورد نظر هستند، به آمپلیکون های اولین واکنش PCR متصل می شوند و منجر به تکثیر توالی مورد نظر می شوند. هدف از این واکنش “Nested PCR” حذف تکثیرغیر اختصاصی یک ناحیه ناخواسته می باشد.
الگو در این واکنش ناحیه تکثیری بزرگتر حاصل از مرحله اول می باشد. . در طی واکنش PCR دوم، مجموعه دوم پرایمرها که مخصوص توالی مورد نظر هستند، به آمپلیکون های اولین واکنش PCR متصل می شوند و منجر به تکثیر توالی مورد نظر می شوند. هدف از این واکنش “Nested PCR” حذف تکثیرغیر اختصاصی یک ناحیه ناخواسته می باشد.
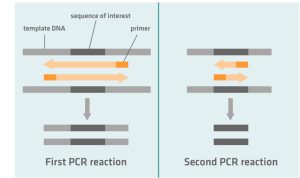
Nested PCR
در Nested PCR که دقت و صحت توالی اهمیت بیشتری دارد، میتوان از آنزیمهایی با عملکرد تصحیحی مانند Pfu DNA Polymerase استفاده کرد. این آنزیم با دقت بالا و قابلیت proofreading، گزینهای مناسب برای تکثیر اختصاصی و بدون خطاست.
روش کلنی PCR | تکنیک کلنی
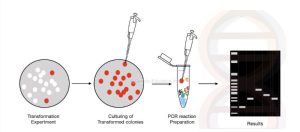
Colony PCR یکی از تکنیک های PCR است که برای بررسی حضور یا عدم حضور بخش DNA مورد نظر که به پلاسمید اضافه و سپس به باکتری منتقل شده است به کار می رود. این یک تکنیک جدید است که به طراحی یک پرایمر خاص برای تکثیر DNA وارد شده به پلاسمید بستگی دارد. از دو نوع پرایمر می توان برای تشخیص DNA وارد شده استفاده کرد، یکی برای تکثیر DNA وارد شده و دیگری برای تکثیر DNA و پلاسمید.
در این روش یک کلنی منفرد انتخاب و مستقیماً به لوله PCR اضافه می شود که این کلنی حامل الگوی DNA است بنابراین در این واکنش الگو به شکل کلنی در کنار تمام اجزای واکنش PCR قرار می گیر و با PCR سنتی در یک مرحله متفاوت است. تفاوت این نوع PCR با PCR معمولی در مرحله استخراج است ، در روش کلنیPCR نیازی به استخراج DNA نیست، بلکه باید یک کلنی انتخاب و به یک میکروتیوب یا لوله منتقل کرد سپس کلنی را در بافر TE حل تا سوسپانسیون حاصل شود و بعد به عنوان نمونه DNA به واکنش اضافه کرد یا حتی می توان کلنی را مستقیم به واکنش اضافه و در آن حل کرد. این تکنیک با توان بالا، سریع و مقرون به صرفه است که تنها در صورت وجود ژن مورد نظر/درج DNA/ژن خارجی تکثیر صورت میگیرد. به این معنی که تنها زمانی کار می کند که تغییر موفقیت آمیز باشد. مزیت اصلی استفاده از کلونی های باکتری به طور مستقیم به عنوان DNA الگو است.
RAPD (Rapid amplified polymorphic DNA analysis):
تکثیر تصادفی پلی مورفیسم DNA (RAP) PCR یکی دیگر از تکنیک های PCR است، مشخصات اصلی این واکنش این است که برای تکثیر الگوی DNA به پرایمر خاصی نیاز ندارد و از پرایمرهای 10جفت بازی کوتاه برای تکثیر اتفاقی DNA ژنومی استفاده می شود. در این تکنیک از بیشتر از یک پرایمر استفاده می شود. مراحل انجام RAPD شامل مراحل اصلی زیر می باشد:
- استخراج DNA هدف
- تکثیر مکان های متعدد DNA هدف با استفاده از پرایمرهای انتخابی تصادفی
- ژل الکتروفورز محصولات PCR تکثیر شده
- بررسی ژل و شناسایی پلی مورفیسم
نتیجه به تعداد نوارهای موجود یا غایب روی ژل آگارز پس از PCR بستگی دارد که نشان دهنده پلی مورفیسم DNA در نتیجه جهش یا هرگونه تغییر در توالی DNA است. به دلیل متغیر بودن اتصال پرایمرها، قطعات مختلف با طول های مختلف در طول تکثیر تولید می شوند. از این رو، الگوهای نواری روی ژل ها در میان افراد و گونه ها متفاوت است. بنابراین، RAPD تشخیص تنوع ژنتیکی در بین موجودات را امکان پذیر می کند.
در تکنیک RAPD که از پرایمرهای تصادفی برای شناسایی تفاوتهای ژنتیکی استفاده میشود، شرایط واکنش بسیار مهم است. مسترمیکسهایی مانند 2X PCR Master Mix با ترکیب بهینهشده و پایداری بالا، امکان اجرای دقیق و بازتولیدپذیر این تکنیک را فراهم میکنند.
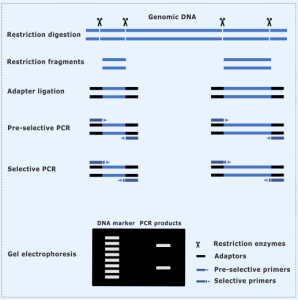
روش پلی مورفیسم طول قطعه تکثیر شده (AFLP) :
AFLP (چند شکلی طول قطعه تقویت شده) یک ابزار مهم در زیست شناسی مولکولی است و به طور گسترده در تجزیه و تحلیل تغییرات ژنتیکی استفاده می شود. AFLP بر اساس تکثیر اختصاصی DNA ژنومی تکه تکه شده و تشخیص پلی مورفیسم توسط اتورادیوگرافی از طریق الکتروفورز ژل است. به طور گسترده ای به شناسایی تفاوت های ژنتیکی در سویه ها یا نمونه های مختلف از جمله گیاهان، حیوانات، باکتری ها و قارچ ها کمک می کند. و را می توان با مقادیر کمی از نمونه های DNA ناشناخته انجام داد. نیازی به دانش قبلی توالی و طراحی پروب ندارد.
مراحل AFLP
- جداسازی DNA
- هضم DNA با اندونوکلئازهای محدود کننده
- اتصال قطعات DNA بریده شده با آنزیم محدود کننده به آداپتورها
- تکثیرانتخابی قطعاتی که جایگاههای اختصاصی آنزیم محدود کننده دارند
- جداسازی محصولات PCR با الکتروفورز ژل
- دیدن ماتریکس ژل توسط اتورادیوگرافی
AFLP روشی حساس تر و قابل تکرار است که می تواند درprofiling DNA چندین گونه از جمله قارچ ها، باکتری ها، گیاهان و حیوانات بدون اطلاع قبلی از توالی DNA استفاده شود. به دلیل حساسیت تشخیصی زیاد، این روش به شناسایی تفاوت های جزئی در بین افراد در جمعیت کمک می کند. AFLP همچنین در نقشه برداری ژنوم، مطالعات پزشکی قانونی، آزمایش والدین، ژنوتیپ و غیره مهم است.
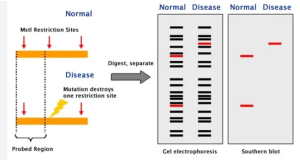
روش Restriction Fragment Length Polymorphism (RFLP) | تکنیک RFLP :
RFLP یکی دیگر از تکنیک های PCR تکنیکی است که برای تشخیص تغییرات ژنتیکی در توالیهای DNA همولوگ استفاده میشود. این اولین روش توسعه یافته برای profiling DNA است. موجودات دارای اثر انگشت DNA یا پروفایل DNA منحصر به فرد هستند. RFLP به عنوان یک ابزار مهم برای تجزیه و تحلیل تنوع بین پروفایل های DNA موجودات درون گونه ای یا نزدیک مرتبط عمل می کند، زیرا توالی های همولوگ دارای جایگاههای محدود کننده متفاوتی هستند که منحصر به یک ارگانیسم خاص است. هنگامی که DNA همولوگ با اندونوکلئازهای محدود کننده خاص هضم می شود، منجر به پروفایل های DNA متفاوتی می شود که برای هر فرد منحصر به فرد است. بنابراین، اصل این روش، تشخیص تنوع ژنتیکی موجودات زنده با برش DNA همولوگ با استفاده از آنزیمهای محدودکننده خاص و تجزیه و تحلیل پلیمورفیسم طول قطعه از طریق الکتروفورز ژل و بلات است. الگوهای بلاتینگ برای هر ارگانیسم منحصر به فرد است و ژنوتیپ های خاص را مشخص می کند.
مراحل روش RFLP
- جداسازی مقدار کافی DNA از نمونه ها
- تکه تکه شدن نمونه های DNA با اندونوکلئازهای محدود کننده خاص به توالی کوتاه
- جداسازی قطعات به دست آمده با طول های مختلف توسط الکتروفورز ژل آگارز.
- پروفیل ژل را با ساترن بلات به غشا منتقل کنید
- هیبریداسیون غشاء با پروب های نشاندار و تجزیه و تحلیل پلی مورفیسم طول قطعه در هر پروفیل
RFLP یک تکنیک بسیار مهم در تشخیص وراثت بیماری و یافتن خطر بروز بیماری در بین اعضای خانواده است. اغلب همچنین اغلب در نقشه برداری ژنوم، شناسایی مجرمان در پزشکی قانونی، آزمایش پدری و غیره استفاده می شود. RFLP دارای محدودیت های متعددی نیز می باشد و به دانش قبلی از داده های توالی برای طراحی پروب ها برای هیبریداسیون نیاز دارد. همچنین برای تجزیه و تحلیل نیاز به جداسازی مقدار کافی DNA از نمونه دارد که در مطالعات پزشکی قانونی دشوار است.
Restriction Fragment Length Polymorphism (RFLP)
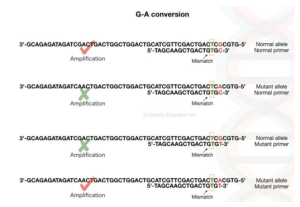
روش ARMS PCR(Amplification of Refractory Mutation system) :
تکنیکی است که برای تشخیص یک تغییر نوکلئوتیدی در توالی استفاده می شود که برای تشخیص جهش شناخته شده استفاده می شود نه جهش جدید ، همچنین به آن “تکثیرPCR آلل های خاص” یا “تک نوکلئوتیدی پلیمراز» گفته می شود .در این روش یک پرایمر خاص برای دو آلل طراحی می شود .که یکی نرمال و دیگری پلی مورفیسم در تک نوکلئوتید است.
دو آغازگر یکی با آلل طبیعی و بقیه با آلل غیر طبیعی (جهش یافته) مطابقت دارد و این بستگی به توالی در پایان 3` دارد. در طراحی پرایمر; تغییر پرایمر باید برای دستیابی به نتایج موفقیت آمیز در نظر گرفته شود .در انتهای نزدیک 3` (2 باز قبل از پایان) یک پرایمر با یک باز که با توالی مطابقت ندارد اضافه می شود، (C: T، G: A، T: T)، این عدم تطابق دمای اتصال را تغییر میدهد، اگر الگو دارای یک باز مکمل (الل نرمال) باشد تکثیر با وجود عدم تطابق قوی انجام خواهد شد ، در حالی که اگر یک باز غیر مکمل در انتهای 3 پرایمر (الل جهش یافته) وجود داشته باشد تکثیر پایان می یابد.
طراحی ARMS
روش Long-range PCR :
محصولات PCR تا 4 کیلوبایت را می توان به طور معمول با استفاده از پروتکل های استاندارد PCR با استفاده از Taq DNA پلیمراز تکثیر کنند. با این حال، تکثیر محصولات PCR بیشتر از 4 کیلوباز اغلب بدون بهینه سازی طولانی با شکست مواجه می شود. دلایل شکست عبارتند از اتصال غیر اختصاصی پرایمر، ساختارهای ثانویه در نمونه DNA، و شرایط چرخه غیربهینه – همه عواملی است که تأثیر بیشتری در تکثیر محصولات PCR طولانیتر از محصولات کوتاهتر دارند. آسیب DNA در طول چرخه PCR را می توان با مواد بافری خاص که pH واکنش را تثبیت می کنند، به حداقل رساند. کیت های PCR تجاری موجود هستند که به طور خاص برای غلبه بر چالش هایlong PCR طراحی شده اند، به عنوان مثال، با استفاده از مخلوط بهینه شده از Taq DNA پلیمراز و آنزیم های Proofreading که منجر به تکثیر بسیار دقیق قطعات بلند میشود دارد و تکثیر قطعات طولانی را با سرعت و وفاداری بالا امکان پذیر می کند.
در Long-range PCR، که برای تکثیر قطعات DNA با طول بالا (تا بیش از 20 kb) استفاده میشود، آنزیمهایی با دقت و پایداری بالا موردنیاز هستند. آنزیمهایی مانند Pfu DNA Polymerase با فعالیت اصلاحی و تحمل بالا در واکنشهای طولانی، گزینهای مناسب برای این تکنیک پیشرفته محسوب میشوند.
روش Fast-cycling PCR
در PCR سریع، مدت زمان مراحل PCR کوتاه میشود تا تکثیر سریعتر انجام شود بدون اینکه بر بازده یا کارایی تأثیر بگذارد. تکثیر سریعتر PCR باعث افزایش توان PCR می شود و به محققان اجازه می دهد زمان بیشتری را برای تجزیه و تحلیل پایین دستی صرف کنند. کاهش زمان رسیدن به نتیجه به واسطه پیشرفت تکنیک های PCR برآورده می شود. fast PCR را میتوان با استفاده از سیکلهایی با زمانهای ramping سریعتر یا به واسطه به کار گیری مواد جدید همانند DNA پلیمرازهای با پردازش بالا، ادغام مراحل اتصال پرایمر و زمانهای گسترش(DNA extension) DNA در صورتی که دمای نزدیکی به هم داشته باشند ، به دست آورد. موادی که درPCR به کار می رود باید به شدت بهینه سازی شود تا از ویژگی و حساسیت تکثیراطمینان حاصل شود.
در تکنیک Fast-cycling PCR که برای کاهش زمان اجرای واکنش به کمتر از 1 ساعت طراحی شده، مسترمیکسهایی مانند super PCR Master Mix و Hotstaramstermix با ترکیب پایدار و واکنش سریع، گزینهای مناسب برای دستیابی به نتایج سریع و قابل اعتماد هستند.
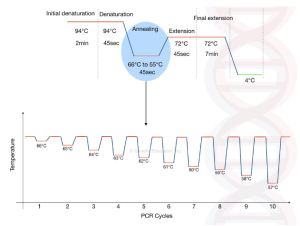
روش Touchdown PCR
روش دیگر برای ارتقای ویژگی، اصلاح پارامترهای PCR است. در تاچ داون PCR، دمای اتصال در چند سیکل اول چند درجه بالاتر از بالاترین دمای ذوب (Tm) پرایمرها تنظیم می شود. . بنابراین پرایمرها فقط می توانند به توالی خاص و مکمل خود متصل شوند. پس از هر چرخه، درجه حرارت 1 درجه سانتیگراد کاهش می یابد. دماهای بالاتر به بی ثباتی تشکیل پرایمر-دایمرها و اتصال غیر اختصاصی پرایمر-نمونه کمک می کند و در نتیجه تکثیر نامطلوب را به حداقل می رساند. به این ترتیب، دمای اتصال بالاتر محصولات PCR غیر اختصاصی را کاهش میدهد و منجر به تکثیر اختصاصی در شروع PCR می شود.
در حالی که در این نوع واکنش از اتصال پرایمر-دایمرها و اتصال پرایمرهای غیر اختصاصی جلوگیری می شود، دمای اتصال بالاتر ممکن است به دلیل افزایش عدم اتصال پرایمرها به توالی مورد نظر، بازده PCR کمتری را به همراه داشته باشد. به همین دلیل، دمای اتصال اغلب 1 درجه سانتیگراد در هر چرخه از چند چرخه اولیه کاهش می یابد تا از توالی مورد نظر به میزان کافی تولید شود. در واقع حتی اگر DNA در چرخه های اولیه به دلیل دمای بالاتر (دمای بالاتر از دمای ذوب) تکثیر نشود، در چرخه های متوالی تکثیر می شود، زیرا بعد از هر چرخه در حال کاهش دما هستیم.
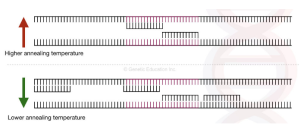
هنگامی که به دمای اتصال رسید یا “پایین” آمد، دمای بهینه(معمولاً 3 تا 5 درجه سانتیگراد کمتر از کمترین Tm پرایمر) ، در طول چرخه های باقیمانده برای اتصال پرایمر حفظ می شود. به این ترتیب، محصولات PCR مورد نظر به طور انتخابی با تکثیر حداقل یا بدون تکثیر توالی غیر اختصاصی در طول PCR افزایش مییابند. زیبایی پشت این تکنیک این است که حتی اگر دما را کاهش دهیم، پس از تقویت الگوی اول، اتصالات غیر اختصاصی ایجاد نمی شود. زیرا هنگامی که توالی DNA مورد نظر ما با موفقیت تکثیر شد، آن DNA تکثیر شده به عنوان الگویی برای چرخه های PCR بیشتر عمل می کند.
روش In situ PCR:
In situ PCR یک واکنش PCR است که در داخل سلول روی یک اسلاید رخ می دهد. بنابراین سوال این است که چگونه PCR روی اسلاید امکان پذیر است؟ زیرا برای انجام تکثیر باید DNA استخراج کنیم.
در این روش تکثیر PCR یا RT-PCR را با هیبریداسیون درجا ترکیب می کند. بنابراین واکنش PCR روی بافت واقع بر روی لام رخ می دهد و به دنبال آن تیمار پروتئولیتیک انجام می شود . PCR در محل اجازه می دهد تا نشانگرهای سلولی شناسایی شوند و بیشتر تشخیص توالی های خاص سلولی در جمعیت های سلولی مانند بافت ها و نمونه های خون را ممکن می کند. بنابراین ابزاری قدرتمند در کاربردهایی مانند مطالعه پیشرفت بیماری است.
از سلولها یا نمونههای بافت تازه یا ثابت میتوان در این روش استفاده کرد، اگرچه آمادهسازی نمونه برای نتیجه بسیار مهم است. این روش برای استفاده با پروب های اسید نوکلئیک نشاندار شده با radiolabeled ، نشاندار شده با فلورسنت یا نشاندار شده با بیوتین مناسب است.فرآیند PCR اساساً مشابه PCR استاندارد است، اما با برخی شرایط واکنش اصلاح شده (مانند غلظت Mg2+).
In situ PCR در سه مرحله انجام می شود:
- آماده سازی بافت برای تکثیر
- هضم پروتئولیتیک
- تکثیر DNA
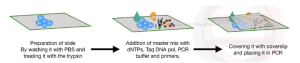
مراحل In situ PCR
بافت روی لام silane-coated ثابت می شود. silane برای تثبیت بافت یا سلول روی لام استفاده می شود، به این معنی که به چسبندگی سلول کمک می کند. پس از تثبیت و تمیز کردن بافت، آنزیم های پروتئولیتیک بخش پروتئینی سلول را هضم می کنند. پپسین، تریپسین و پروتئیناز K به طور کلی در واکنش هضم استفاده می شود. پپسین، تریپسین و کیموتریپسین همیشه در هضم In situ PCR به دلیل طول عمر کوتاهتر آن ترجیح داده میشوند. پس از پایان هضم، مسترمیکس تخصصی به همراه پرایمرها و سایر افزودنی های PCR روی سطح سلول اضافه می شود. پس از پوشاندن آن، لام مستقیماً در ترموسایکلر برای تکثیر قرار می گیرد. بازده واکنش به نحوه آماده سازی نمونه برای تکثیر بستگی دارد. با استفاده از PCR درجا (In situ) حتی یک کپی از DNA موجود در نمونه را می توان اندازه گیری یا تکثیر کرد.از این روش به طور گسترده در مطالعه ارگانوژنز و جنین زایی استفاده می شود، همچنین در تشخیص بیماری های عفونی مانند HIV استفاده می شود.تعیین کمیت DNA نیز با In situ Realtime PCR امکان پذیر است. همچنین می توان بیان ژن را با استفاده از In situ RT-PCR نیز اندازه گیری کرد.
WWW.greenbiogene.com/troubleshouting-for-pc




