تلومر، طول تلومر و ارزیابی طول تلومر
- آیا ارزیابی طول تلومر با روش کیفی qPCR امکان پذیر هست ؟
- آنزیم تلومراز چیست؟
- تلومر چیست ؟
- کاهش تدریجی طول تلومر چه نتایجی در بر دارد؟
- همانندسازی تلومر چگونه انجام میشود؟
در ادامه خواهید خواند…
تلومر:
بیش از هفتاد سال قبل Muller و MCclintak نشان دادند که انتهای کروموزوم های یوکاریوتی یک ساختار متفاوت دارد. Muller نتیجه گرفت که انتهای یوکاریوتی باید یک ساختار خاصی داشته باشد که باعث انسجام ساختاری کروموزوم شود و نام آنرا ” تلومر” نهاد .تلومرها ساختارهای متمایزی هستند که در انتهای کروموزوم های ما یافت می شوند. آنها از همان توالی DNA کوتاه تشکیل شده اند که بارها و بارها تکرار می شوند. تلومرها از انتهای کروموزوم ها محافظت می کنند. هر بار که یک سلول تقسیم می شود، تلومرها کمی کوتاه تر می شوند. در نهایت آنقدر کوتاه می شوند که سلول دیگر نمی تواند با موفقیت تقسیم شود و سلول می میرد. در دهه های بعدی نشان داده شده است که این گستردگی کروموزوم شامل تکرارهای غنی از G بوده و در انسان به شکل تکرار های TTAGGG می باشد ساختار ناحیه ی تلومریک در میان موجودات زنده از مخمر تا انسان به طور عمده حفظ شده است. تلومر از یک توالی دو رشته ای غنی از G و یک بخش تک رشته ای تحت عنوان overhang-G تشکیل شده است.شکل زیر ساختار تلومر را نشان می دهد.
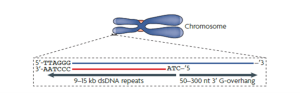
ساختار تلومر
این ساختار تک رشته ای در شکل گیری ساختار دوم T-loop دخیل می باشد و علاوه بر اینکه ساختار لازم برای عملکرد تلومراز را فعال می کند، برای عملکرد مناسب تلومر نیز لازم می باشد . تلومرها با یک خمیدگی بر روی خود یک ساختار لوپ مانند به نام T-loop شکل می دهند.
کوتاه شدن تلومر:
سلول های طبیعی در بدن دارای ظرفیت محدودی برای رشد بوده و بعد از سپری شدن چرخه های سلولی متعددی وارد مرحله ی پیری سلولی می شوند . پیری سلولی با کوتاه شدن انتهای کروموزوم همراه است، این کوتاه شدن حاصل فرآیند طبیعی تکثیر DNA می باشد که با هر بار تکثیر کروموزومی 100-200 جفت باز از طول تلومرکم می شود. کوتاه شدن تدریجی تلومرها، به میزان 200 جفت باز در هر تقسیم سلولی، به عنوان یک ساعت سلولی عمل می کند که چرخه سلول هایی که تعداد زیادی تقسیم را پشت سر گذاشته اند و جهش های زیادی را به دست آورده اند، تضمین می کند. در پایان این فرآیند که حد Hayflick نامیده میشود، تلومرها بسیار کوتاه شده و پیری سلولی حاصل میشود.
فرض کردند که DNAدر هر تقسیم سلولی باید از انتهای کروموزوم از دست برود چون DNA پلیمراز نمی تواند انتهایʹ3 در رشته ی پیرو را همانند سازی کند . همانندسازی رشته ی پیشرو به صورت پیوسته می باشد در حالیکه همانندسازی رشته ی پیرو به واسطه ی شکل گیری قطعات اکازاکی صورت می پذیرد، دراین مسیر آخرین قطعه ی اکازاکی نمی تواند تا انتها سنتز شود و بخشی از DNA در انتهای یک کروموزوم یوکاریوتی در هر دور همانندسازی بدون کپی می ماند و یک overhang تک رشته ای باقی می ماند. در طول چندین دور تقسیم سلولی، کروموزوم با تکرار این فرآیند کوتاهتر و کوتاهتر میشود.در نتیجه در هر تقسیم کروموزوم در انتهایʹ3 خود کوتاه می شود، این پدیده مشکل انتهای همانندسازی نام دارد.
تلومراز:
مشکل کوتاه شدن انتهای کروموزوم در همانندسازی، طی تکامل به واسطه ی آنزیم تلومراز حل می شود. تلومراز یک آنزیم رونویسی است که تکرارهای تلومریک را بعد از هر تقسیم به انتهای آن اضافه می کند و بدین ترتیب با مشکل انتهای همانندسازی مقابله می کند . تلومراز آنزیمی است که از دو زیر واحد به نامهای (TR) TERC و hTERT(TERT) تشکیل شده است .زیر واحد TERT فعالیت آنزیمی داشته و از الگوی RNA ای که توسط زیر واحد TERC فراهم می شود، استفاده کرده و تکرارهای تلومریک را از روی آن سنتز می کند، بدین ترتیب منجر به حفظ طول و ساختار تلومری می شود. با توجه به اینکه زیرواحد RNA در تمام بافتها بدون توجه به فعالیت تلومراز بیان می شود، بنابراین نمی تواند به عنوان عاملی برای تعیین فعالیت تلومراز در نظر گرفته شود .به طور عمومی زیر واحد TERT در سلول های طبیعی مهار می شود و در سلول های نامیرا افزایش می یابد که در نتیجه میتوان گفت که TERT برای فعالیت آنزیم تعیین کننده است . اما در هر صورت کمبود هر یک از دو زیر واحد TERT یا TERC فعالیت تلومراز را مختل می کند و منجر به تلومر کوتاه می شود.
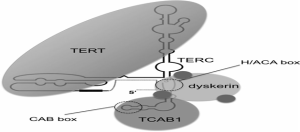
TERT

افزایش طول تلومر:
برخی از سلولها، یعنی سلولهای با عمر طولانی مانند سلولهای بنیادی و پیشساز اولیه، نیاز به نگهداری این توالیهای تلومری دارند تا بتوانند برای مدت طولانی تری زنده بمانند. در طول تقسیم سلولی، ژنوم توسط آنزیم DNA پلیمراز تکثیر می شود. با این حال، توالی های DNA تکراری تلومریک در هر بار تکثیر کوتاه می شوند و این کوتاه شدن طول عمر اکثر سلول ها را محدود می کند. در طول پیشرفت سرطان، سلول ها نیاز دارند تا بتوانند به صورت نامحدود به واسطه غلبه بر چرخه کوتاه شدن تلومر تکثیر شوند .این امر یا به واسطه افزایش بیان تلومراز یا با فعال شدن مکانیسم ALT بر پایه روش های رایج تعمیر DNA، نوترکیبی هومولوگ انجام می پذیرد.
تلومراز به تدریج توالی تلومر را به انتهای تلومرها اضافه می کند. بیان و فعالیت تلومراز به شدت کنترل می شود و استفاده از آن در سلول های در حال تقسیم طبیعی محدود می شود. بسیاری از سرطانها( 85 تا 97 درصد) از این مکانیسم طبیعی افزایش طول تلومر استفاده میکنند و از آن برای حفظ تلومرهای خود استفاده میکنند و به آنها اجازه میدهند از بحران تلومر فرار کنند. با این حال، تعداد کمی از سرطانها مکانیسمهای مستقل از تلومراز را برای افزایش طول تلومر به کار گرفته اند. این سرطان ها، در مجموع، به عنوان سرطان های Alternative Lengthening of Telomeres (ALT) نامیده می شوند.
در طول نوترکیبی همولوگ، شکستگی دو رشته ای در DNA یک کروموزوم توسط DNA پلیمراز ترمیم می شود. سلول های سرطانی که از ALT استفاده می کنند اغلب سطح بالاتری از آسیب DNA در تلومرها را نسبت به سلول هایی که از مکانیسم غیر ALT استفاده می کنند نشان می دهند. در مکانیسم ALT در رده سلول های سرطانی انسانی، شواهد نشان دهنده افزایش نوترکیبی همولوگ در تلومرها به واسطه افزایش تبادل تلومر بین کروماتیدهای خواهری در مقایسه با سایر رده های سلولی می باشند.
همانندسازی تلومر:
بخش عظیمی از DNA تلومریک توسط همانندسازی نیمه حفاظت شده (semiconservative) همانندسازی می شود. رشته G به عنوان یک الگو برای سنتز رشته lagging و رشته C برای سنتز رشته leading عمل می کند.در سالهای اخیر مشخص شده است که برای همانند سازی نیمه حفاظت شده DNA تلومریک به هلیکازها و پروتئین های متصل شونده به تلومر نیاز دارد. هلیکاز ها در طول همانند سازی DNA تلومریک چندین نقش ضروری دارند. اول از همه هلیکازها ساختارهای G-quadriplex راکه ممکن است در هنگام همانندسازی رشته lagging ایجاد شوند از هم باز کنند. دوم اینکه هلیکازها برای باز شدن ساختار T-loop در طول همانندسازی ضروری هستند و سوم اینکه اگر ساختار TERRA به همراه تلومر یک R-loop شکل دهند به وجود هلیکاز برای جداکردن تک رشته DNA به منظور جلوگیری از شکل گیری شکست های دو رشته DNA، نیاز است.
سنتز رشته ی leading منجر به شکل گیری یک دو رشته ای blunt می شود. این حد واسط فرضی قابل تشخیص نیست، زیرا به سرعت پردازش می شود تا یک overhang 3′ را بازسازی کند. بنابراین، رشته غنی از C در انتهای 5′ برداشته می شود. 3′ overhang غنی از G یک سوبسترا برای تلومراز فراهم می کند علاوه بر اینکه یک جایگاهی برای اتصال پروتئین های تلومری و توانایی حمله به بخش دو رشته ای تلومری در ساختار T-loop فراهم می کند. بنابراین تلومر در رشته leading به دلیل اینکه رشته الگو غنی از C در هر بار تکثیر برداشته می شود، کوتاه می شود. در طول سنتز رشته lagging ،پرایمرهای RNA کوتاه متشکل از 8 تا 14 نوکلئوتیدی توسط پرایماز سنتز شده و بسط داده می شوند.
در شکل زیر مشکل انتهای همانندسازی و برداشته شدن DNA انتهایی نشان داده شده است. رشته غنی از G به عنوان رشته الگو برای سنتز رشته lagging و رشته غنی از C به عنوان رشته الگو برای سنتز رشته leading عمل می کند.
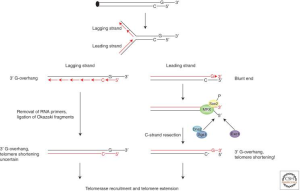
و برداشته شدن DNA انتهایی
اندازه گیری طول تلومر:
درک مزایا و معایب روشهای اندازهگیری TL مهم است زیرا تلومرهای کوتاه، نه TL متوسط، تقسیم طولانیمدت سلولهای بنیادی را که برای تجدید بافت ضروری است، محدود میکنند. علاوه بر این، اختلالات ژنتیکی مؤثر بر تلومرها (اختلالات طیف تلومر یا تلومروپاتی) وجود دارد که منجر به شروع زودتر بیماری در زمانی که تلومرها کوتاه هستند می شوند. بنابراین، اندازهگیریهای قوی و قابل تکرار TL از آنجا که می تواند شروع برخی از آسیب های ژنتیکی و مرتبط با سن در انسان و سایر گونههای حیوانی را پیشبینی کند، مهم هستند.
کاهش تدریجی طول تلومر منجر به اختلال عملکرد تلومر می شود و با بسیاری از بیماری های مرتبط با سن مانند ناباروری، دیابت، سرطان، بیماری های قلبی عروقی مرتبط است .شکل زیر ارتباط کوتاه شدن تلومر را با ظهور بیماری ها نشان می دهد.
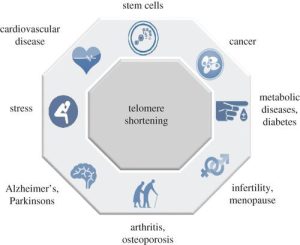
کاهش تدریجی طول تلومر
روش های اندازه گیری طول تلومر:
در این روش با مقدار بسیار کم از DNA اولیه می توان طول تلومر را ارزیابی کرد. در این ارزیابی طول تلومر نسبت به یک ژن کنترل (reference single-copy) اندازه گیری می شود یعنی نسبت طول تلومر به ژن کنترل محاسبه می شود.
Terminal Restriction Fragment analysis
تجزیه و تحلیل TRF، شدت اسمیر تلومر را برای تعیین میانگین TL اندازه گیری می کند. وقتی که طیف وسیعی از اندازههای تلومر را میتوان در ساترن بلات مشاهده کرد، کوتاهترین تلومرها نمی توانند قابل دیدن باشند. DNA ژنومی به واسطه آنزیم های محدود کننده به قطعات کوچک تر تقسیم می شود ، توالی های تلومر تکراری (TTAGGGn) به دلیل اینکه جایگاه برشی برای آنزیم های محدود کننده ندارند ،بریده نمی شوند. بنابراین، انتهای تلومر در سلولهای طبیعی انسان هضم نشده باقی میماند (هرچند دارای طولهای متغیر)، در حالی که بقیه DNA ژنومی به قطعات کوچک بریده میشود.
Quantitative Fluorescence In Situ Hybridization:
TLها را می توان با استفاده از چندین روش Q-FISH که بر اساس اصول مشابه اما با برخی تغییرات برای کاربردهای مختلف است، اندازه گیری کرد. در اینترفاز Q-FISH از یک میکروسکوپ برای تعیین شدت فلورسانس تلومر پس از هیبریداسیون با یک پروب تکرار تلومریک که یک پپتید نوکلئیک (PNA) فلورسنت است، استفاده می کنند.
Telomere dysfunctional Induced Foci analysis:
یک سنجش اختلال عملکرد تلومر که برای مطالعات آسیب DNA مفید است، آنالیز TIF یا Telomere dysfunctional Induced Foci است. این روش عموماً بر روی سلولهای اینترفاز در شرایط آزمایشگاهی یا در بخشهای بافتی انجام میشود و عموماً شامل استفاده از دو آنتیبادی است، یکی برای یک پروتئین Shelterin مانند TRF2، و دیگری برای یک آنتیبادی که شکستگیهای دو رشتهای DNA را تشخیص میدهد، مانند گاما H2AX یا 53BP1. . همچنین می توان از یک پروب تکرار تلومری PNA برای co-localize با گاما H2AX یا 53BP1 استفاده کرد.این سنجش ممکن است به عنوان یک نشانگر زیستی برای دنبال کردن آزمایشهای بالینی که تلومراز را مهار میکنند،کاربردی باشند.
با این حال، این سنجش اطلاعاتی در مورد TL ارائه نمی دهد، فقط برخی از تلومرها آنقدر کوتاه یا بدون کلاه هستند که به صورت DNA آسیب دیده ظاهر می شوند. در ترکیب با TRF یا ترکیب با Q-FISH، تجزیه و تحلیل TIF می تواند اطلاعاتی در مورد میانگین TL زمانی که تلومرها به اندازه کافی کوتاه هستند که منجر به بیماری شوند، ارائه دهد.
Single Telomere Length Analysis:
تجزیه و تحلیل طول تلومر منفرد (STELA) برای اندازهگیری تلومرها روی هر کروموزومهای مجزا طراحی شد. STELA فراوانی کوتاهترین تلومرها را با استفاده از ligation، روشهای مبتنی بر PCR و آنالیز ساترن بلات اندازهگیری میکند.
Telomere Shortest Length Assay
یک روشی حساستر، دقیقتر و بیطرفتر برای اندازهگیری طول تمام تلومرها از جمله کوتاهترین تلومرها بدون شناسایی ITS، روش جدیدی به نام TeSLA است. TeSLA به مقادیر کمی (کمتر از یک میکروگرم) از DNA اولیه نیاز دارد و از یک استراتژی ligation و هضم آنزیمی، آنالیز ساترن بلات کلاسیک با پروب بسیار حساس با برچسب دیگوکسیژنین و نرمافزار پردازش تصویر کاربرپسند برای اندازهگیری خودکار استفاده میکند.
آیا ارزیابی طول تلومر با روش کیفی qPCR امکان پذیر هست ؟
بله، در این روش با مقدار بسیار کم از DNA اولیه می توان طول تلومر را ارزیابی کرد. در این ارزیابی طول تلومر نسبت به یک ژن کنترل (reference single-copy) اندازه گیری می شود یعنی نسبت طول تلومر به ژن کنترل محاسبه می شود.
آنزیم تلومراز چیست؟
تلومراز یک آنزیم رونویسی است که تکرارهای تلومریک را بعد از هر تقسیم به انتهای آن اضافه می کند و بدین ترتیب با مشکل انتهای همانندسازی مقابله می کند . تلومراز آنزیمی است که از دو زیر واحد به نامهای (TR) TERC و hTERT(TERT) تشکیل شده است.
تلومر چیست ؟
تلومرها ساختارهای متمایزی هستند که در انتهای کروموزوم های ما یافت می شوند. آنها از همان توالی DNA کوتاه تشکیل شده اند که بارها و بارها تکرار می شوند.
کاهش تدریجی طول تلومر چه نتایجی در بر دارد؟
کاهش تدریجی طول تلومر منجر به اختلال عملکرد تلومر می شود و با بسیاری از بیماری های مرتبط با سن مانند ناباروری، دیابت، سرطان، بیماری های قلبی عروقی مرتبط است.
همانندسازی تلومر چگونه انجام میشود؟
بخش عظیمی از DNA تلومریک توسط همانندسازی نیمه حفاظت شده (semiconservative) همانندسازی می شود. رشته G به عنوان یک الگو برای سنتز رشته lagging و رشته C برای سنتز رشته leading عمل می کند.


