ارتباط مستقیم با کارشناس فروش
تکنیک LAMP – روش و کاربردهای آن
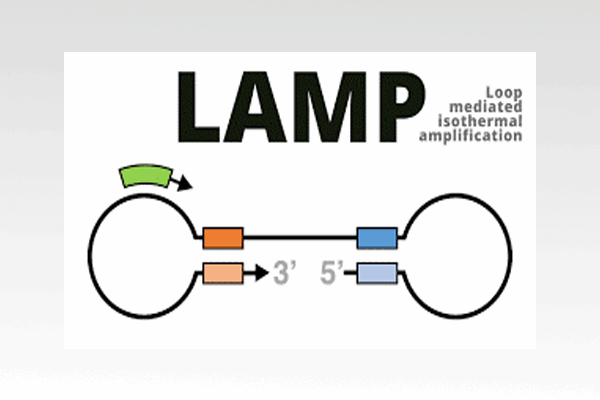
تکنیک LAMP
تکنیک (LAMP ( Loop-mediated isothermal amplification یا بعبارتی تکثیر همدمای متصل به حلقه یا تکثیر ایزوترمال متصل به حلقه ، یک تکنیک تکلولهای برای تکثیر DNA است. این روش انقلابی در آزمایشگاه های تشخیصی برای تشخیص بیماری های خاص بوده است . همچنین این تکنیک ممکن است با رونویسی معکوس برای شناسایی RNA نیز ترکیب شود.
روش LAMP
کاربردها و مزایای تکنیک LAMP
LAMPیک تکنیک نسبتاً جدید برای تکثیر DNA است که به خاطر کم هزینه و ساده بودن روش ، میتواند مزایای زیادی در آزمایشگاه ها داشته باشد. تکنیک LAMP میتواند به عنوان یک تست غربالگری ساده در زمینه مراقبت توسط پزشکان مورد استفاده قرار گیرد. از آنجایی که تکنیک LAMP به صورت ایزوترمال است و نیاز به ترموسایکلر گرانقیمت درتکنیک PCR معمولی را مرتفع میکند.
همچنین LAMP می تواند یک تکنیک بسیار ارزشمند برای تشخیص بیماریهای عفونی در کشورهای کم درآمد و متوسط باشد.
LAMP در مقایسه با PCR نسبت به مهارکنندههای موجود در نمونههای پیچیده مثل خون حساسیت کمتر و مقاومت بیشتری دارد و این وجه تمایز به دلیل استفاده ازیک آنزیم DNA پلیمراز متفاوت بنام آنزیم Bst DNA polymerase است. گزارشهای متعدد حاکی از موفقیتآمیز بودن تشخیص پاتوژنها در نمونههای کمتر فراوری شده مثل خونگرم شده یا در حضور نمونه بالینی است. این متمایز بودن تکنیک LAMP ممکن است در تنظیمات کم منابع یا کم زمینه مفید باشد، زیرا استخراج DNA یا RNA متعارف قبل از آزمایشهای تشخیصی غیرممکن است.
محدودیت های تکنیک LAMP
تکنیک LAMP در مقایسه با متداول ترین روش تکثیر DNA ( PCR) بطور ویژه ای یک روش تشخیصی مفید تلقی میشود ولی برای کلونینگ و هزاران کاربرد زیستشناسی مولکولی که با PCR انجام میشوند، ناکارآمد است؛ زیرا در روش LAMP از ۴یا۶ پرایمر استفاده میشود که ۶ یا ۸ ناحیه را در یک بخش نسبتاً کوچک از ژنوم، هدف قرار میدهد و چون طراحی پرایمر محدودیتهای زیادی دارد، طراحی آنها با چشم مشکل میشود. بهطور کلی برای کمک به طراحی پرایمر، بستههای نرمافزاری رایگان یا تجاری مورد استفاده قرار میگیرند، گرچه محدودیتهای طراحی پرایمر به معنای آزادی کمتر در انتخاب توالی هدف نسبت به PCR است.
رویکردهای Multiplexing برای LAMP کمتر از PCR توسعه یافتهاست. تعداد بیشتر پرایمر به ازای هر هدف در LAMP احتمال برهم کنش پرایمر-پرایمر را افزایش میدهد. محصول روشLAMP یک مجموعه به هم پیوسته از منطقه هدف است که باعث ایجاد یک حالت نردبانی روی ژل میشود. بر خلافPCR که یک باند واحد روی ژل تشکیل میشود.
اگر چه این مسئله هنگام شناسایی اهداف واحد مشکلی ایجاد نمیکند، اما برنامههای PCR چندگانه سنتیend point که در آن هویت یک هدف توسط اندازه باند بر روی ژل تعیین میشود با LAMP امکانپذیر نیست. Multiplexing در LAMP با انتخاب یک منطقه هدف با توالی محدود و دستیابی به تجزیه قبل از اجرا بر روی ژل انجام میشود. به طوری که هر محصول با اندازه خاص خودش مشخص میشود. اگرجه این روش باعث پیچیدگی دستورالعمل و طراحی تجربی میشود.
📌بیشتر بخوانید : انواع تکنیک های RFLP | Nested PCR | PCR | کلنی PCR




